“기술 혁신성 다시 한번 인정받았다”
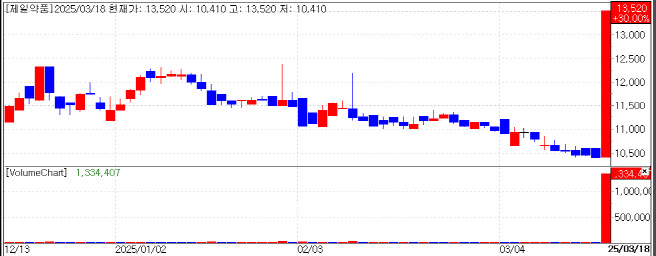
18일 KG제로인 엠피닥터(MP DORTOR·옛 마켓포인트)에 따르면 제일약품(271980)은 전 거래일 대비 3120원(30%)오른 1만3520원에, 자회사 온코닉테라퓨틱스(476060)는 4160원(29.97%) 상승한 1만8040원에 각각 거래를 마쳤다. 지주사인 제일파마홀딩스(002620)도 1070원(14.60%)오른 8400원에 장을 마감했다.
|
네수파립은 앞서 2021년 췌장암 치료제로 미국 식품의약국(FDA)와 국내 식품의약품안전처로부터 희귀의약품을 한 차례 지정받은 바 있다. 이번 신규 희귀의약품 승인으로 온코닉은 위암 및 위식도접합부암 치료제 개발분야에서도 기술적 혁신성과 치료 가능성을 다시 한번 인정받았다고 설명했다.
네수파립은 암세포의 생존과 관련된 두 가지 단백질인 ‘PARP’(Poly ADP-ribose polymerase)와 ‘Tankyrase’를 동시에 억제하는 신약 후보 물질이다. 이를 통해 암세포가 스스로 사멸하도록 유도하는 차세대 표적항암제다.
업계에서는 FDA의 희귀의약품지정(ODD) 승인 비율이 약 17.6%에 불과하다는 점을 고려할 때, 네수파립의 희귀의약품 지정이 기술적으로나 신뢰도 상승 측면에서나 큰 의미가 있다고 판단하고 있다. 또 FDA의 신약 승인 사례 중 희귀의약품 지정됐던 신약 후보물질 최종 허가 비율이 높기 때문에 네수파립 역시 상업화 가능성이 높은 기술로 평가받고 있다고 회사 측은 설명했다. 실제 2022년 FDA에서 허가받은 신약 중 약 49%가 희귀의약품으로 지정됐던 후보물질이었다.
제일약품 관계자는 이번 주가 상승에 대해 “네수파립이 본격적으로 시장가치를 인정받게 되면 밸류업을 통한 성장이 기대된다”며 “자체 신약으로 매출을 확보하고 신약연구를 이어가면서 글로벌 기업으로 성장하면 기업가치 재평가 작업이 이뤄질 것으로 기대한다”고 말했다.
온코닉은 기존에 미국 식품의약국(FDA)로부터 희귀의약품으로 승인받았던 췌장암 적응증에 대해 임상1b/2상을 진행 중이며, 키트루다 병용으로 자궁내막암 연구자 임상 2상을 진행중이다. 업계에서는 위암의 FDA 희귀의약품 추가 승인에 따라 온코닉이 위암 임상에 신규 진입할 것으로 예측하고 있다.
온코닉은 올해 4월 진행되는 미국암연구학회(AACR 2025)에서 네수파립 연구성과를 발표할 예정이다.
기술이전, 투자유치 힘준다
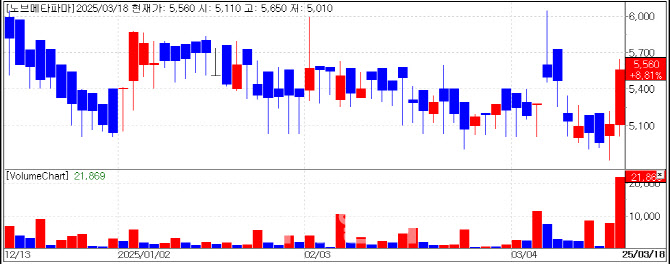
코넥스 신약개발업체 노브메타파마 주가는 이날 450원(8.81%) 오른 5560원에 장을 마쳤다. 코넥스 시장의 경우 상한가 제한폭이 15%라는 점을 감안하면 높은 상승률이다. 주가 상승 배경으로는 팜이데일리가 보도한 <2조 블록버스터 주역 PTC 대표, LOC(협력서한) 들고 노브메타파마 합류> 기사가 영향을 미친 것으로 풀이된다. 해당 기사는 지난 17일 유료 기사로 출고됐고 18일 오전 9시 56분 무료로 전환됐다.
|
가장 눈에 띄는 업적으로는 글로벌 제약·바이오사 로슈에 이전한 척수성 근위축증(SMA) 경구용 치료제 ‘에브리스디’(성분명: 리스디플람)의 상용화다. 펠츠 전 CEO가 기술개발부터 이전, 상업화까지 핵심 역할을 했다.
PTC와 로슈는 에브리스디의 미국 식품의약국(FDA) 승인을 2020년 받았다. 불과 4년 만에 에브리스디는 현재 로슈의 핵심 매출처의 하나이자 블록버스터 신약으로 성장했다. 지난해 매출은 전년 대비 18% 성장한 16억 프랑(CHF, 약 2조 6000억원)에 달했다. 펠츠 전 CEO는 노브메타파마에서 해외사업 총괄을 맡을 예정이다.
펠츠 전 CEO와 에브리스디의 상업화를 함께 진행했던 카일리 오키프 PTC 전 최고사업화책임자(CCO)도 노브메타파마에 합류한다. 그는 기술도입 이전, 사업 개발과 투자자 관계 관리, 자본조달 분야의 글로벌 전문가로 꼽힌다. 50개국 이상에서 희귀 신경질환 및 대사질환 제품 6종에 대한 글로벌 상업 전략 및 포트폴리오를 관리한 바 있다. 노브메타파마에서는 최고운영책임자(COO)로서 소임을 다한다.
실제 두 전문가는 노브메타파마의 제안이 아닌 이 회사의 핵심 파이프라인의 가능성을 보고 직접 협력 의사를 타진한 것으로 알려졌다. 이 과정에서 유전성 근질환 치료제에 특화된 캐나다의 유력 기관으로부터 노브메타파마가 협력서한(LOC)을 받는 데도 기여했다. 유전성 근질환 치료제 추가 연구개발 진행을 위한 LOC다. 해당 기관은 노브메타파마의 유전성 근질환 치료제 데이터를 확인 후 연관 적응증에서 효능을 확인하기 위해 테스트를 진행해왔다.
이헌종 노브메타파마 부사장은 “글로벌 기업의 권위 있는 연구자의 합류로 노브메타파마의 기술에 대한 신뢰는 더욱 커졌다”며 “치료제가 없는 근육성 치료제 연구와 상용화에 핵심적인 역할을 할 것”이라고 설명했다.
노브메타파마는 이번 키맨 합류를 기점으로 기술이전과 투자 유치 등에 주력한다는 계획이다. 이를 바탕으로 하반기 코스닥 이전상장에 재도전할 예정이다.
세계 최초 골관절염 근원 치료제 노린다
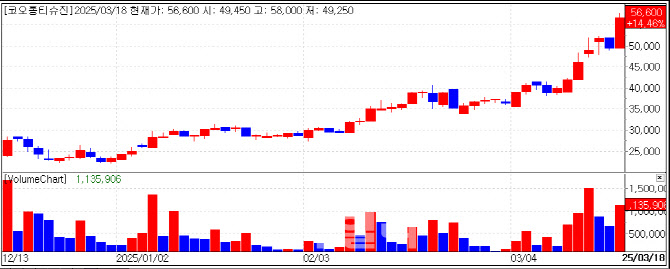
코오롱티슈진 주가는 이날 7150원(14.46%) 오른 5만660원에 장을 마쳤다. 골관절염 세포 유전자 치료제 ‘TG-C’의 미국 품목허가 기대감이 반영된 것으로 풀이된다.
|
TG-C는 한 번의 주사로 약 2년간 통증 완화와 관절 기능 개선 효과를 기대할 수 있는 혁신적인 골관절염 세포유전자 치료제다. 회사에 따르면 임상 2상에서 약 86%의 반응률을 기록하며 기존 치료제 대비 월등한 효능을 입증했다.
코오롱티슈진은 2028년 품목허가와 동시에 무릎 골관절염 근원 치료제(DMOAD) 지위 획득도 기대하고 있다. 현재 FDA로부터 DMOAD 지위를 획득한 골관절염 치료제는 없다.
위해주 한국투자증권 연구원은 기업분석 보고서에서 “TG-C가 질병을 조절하는 골관절염 치료제(DMOAD)로 승인받는다면 판매액은 70억~82억달러에 달할 수 있다”며 “영업이익률 55%를 가정한다면 70억달러 매출 달성 시 영업이익은 한화로 약 5조5000억원에 달한다”고 밝혔다.
최근 주가 상승에 대해 코오롱티슈진 관계자는 “지난해 11월 무죄 판결 이후에 티슈진에 대한 기본적인 신뢰도가 바탕이 된 상황에서 최근 미국 현지 기자간담회 등으로 TG-C의 품목허가 가능성을 시장에서 긍정적으로 보는것이 원인 중 하나 아닐까 생각한다”고 말했다.
코오롱티슈진의 TG-C는 2017년 한국에서 출시됐었지만 해당 세포의 유래가 잘못 기재된 것이 발견돼 2019년 식품의약품안전처의 허가 취소 처분을 받았다. 이로 인한 소송전이 진행 중이며, 지난해 11월 형사재판 1심에선 전체 무죄 판결이 나왔다.